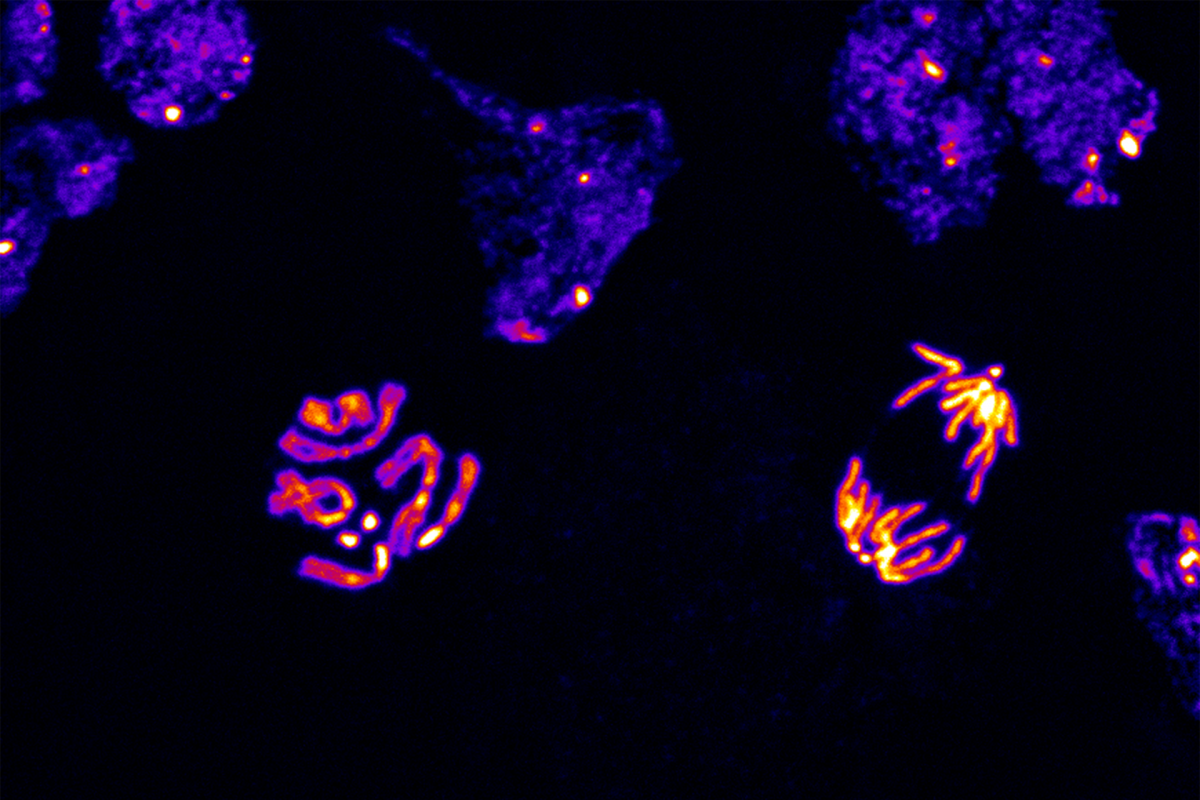
Equipa do Porto conseguiu perceber o funcionamento do mecanismo que divide cromossomas, o que pode permitir corrigir erros da divisão celular, nomeadamente em casos de cancro.
Investigadores do Porto conseguiram determinar o funcionamento do mecanismo que inicia a separação dos cromossomas quando as células se dividem, o que pode vir a permitir controlar erros na divisão celular que estão na origem do cancro.
Erros na divisão dos cromossomas podem originar células com um número anormal dessas moléculas e, ocorrendo em células adultas, “potenciar as etapas iniciais de carcinogénese” e aumentar a resistência das células cancerígenas a fármacos usados em quimioterapia, explicou à Lusa o investigador do Instituto de Investigação e Inovação em Saúde (i3S) Carlos Conde.
Quando os erros na divisão celular ocorrem nas células reprodutivas, podem levar ao abortos e ao desenvolvimento de defeitos congénitos, como o Síndrome de Down, acrescentou o especialista, um dos oito membros da equipa de investigação.
De acordo com o investigador, as células, quando se dividem, através de um processo denominado mitose, possuem um conjunto de mecanismos que garantem que todos os passos sejam controlados e funcionem na perfeição, sendo uma dessas etapas a divisão dos cromossomas.
Existe na célula “uma espécie de ponto de controlo, que garante que todos os cromossomas são posicionados de forma alinhada num plano de partida, como se de uma corrida se tratasse”, indicou Carlos Conde, acrescentando que nesta investigação foi desvendado como funciona o “tiro de partida” que “autoriza a separação e a migração” dessas moléculas.
Esse processo, continua o investigador, é realizado através de uma proteína fosfatase (tipo de proteína que regula e remove seletivamente os fosfatos presentes nas restantes), designada PP1, que separa os cromossomas no momento certo, de forma a finalizar a divisão “sem caos total”.
Segundo o investigador, o ponto de controlo que mantém os cromossomas “na dita linha de partida” é imposto pela atividade de uma outra proteína, a MPS1, e a autorização é concedida quando a PP1 entra em ação para inativar a MPS1.
“Fazendo o paralelo com uma corrida de cavalos, as MPS1 são as portas de barreira que se mantêm fechadas até todos os concorrentes estarem nas respetivas boxes”, exemplificou o especialista, enquanto a PP1 desempenha “a função de ‘starter’ (iniciadora), inativando as MPS1 e dando assim o “tiro de partida” que permite a abertura de todas as portas em simultâneo”.
Carlos Conde indica que, para a qualidade da divisão celular, cujo objetivo é gerar duas cópias genéticas da célula progenitora, é preciso dar tempo a esta para que consiga alinhar todos os cromossomas na zona central.
Se a separação dos cromossomas ocorrer antes disso, poderá resultar numa “distribuição desigual do material genético pelas células filhas”, contudo, “a incapacidade em separar prontamente os cromossomas uma vez alinhados é igualmente danosa”, referiu.
Quando uma separação não acontece no tempo certo resulta frequentemente em células com um número alterado de cromossomas, “uma condição conhecida como aneuploidia”, “intimamente associada ao desenvolvimento de vários tipos de cancro”.
O investigador indica que a MPS1, a “tal barreira”, está frequentemente hiperativa em células cancerígenas, e o seu excesso impede a “separação fidedigna dos cromossomas”, contribuído assim para a acumulação de erros nestas células.
Dando seguimento aos resultados deste estudo, os investigadores estão agora “mais capacitados para intervir em células anómalas, que apresentam defeitos no processo de divisão celular”, podendo desenhar estratégias para manipular a atividade da MPS1 e da PP1, ou a interação entre estas proteínas, de forma a promover a morte seletiva de células tumorais.
Os resultados desta investigação, que teve a duração de três anos, foram recentemente publicados na revista ‘eLIFE’.